דף הבית > חומצה פולית > פולאט בפורמולה משופרת: המפתח לזמינות ביולוגית גבוהה – יציבות ומסיסות

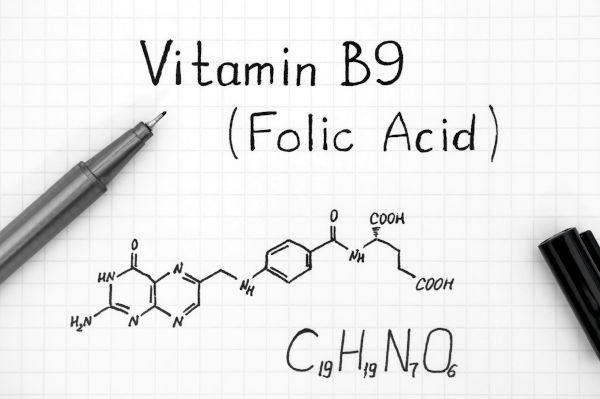
פולאט וחומצה פולית הן שתי נגזרות שונות של ויטמין B9 – ויטמין מסיס במים מקבוצת ויטמיני ה-B, שמצוי באופן טבעי במזונות מהטבע. פולאט הוא הצורה הטבעית והפעילה ביולוגית של הוויטמין, ואילו החומצה הפולית היא צורה סינתטית שלו. בשל המבנה הכימי השונה של כל אחת משתי הנגזרות, תהליך חילוף החומרים שהן עוברות בגופנו שונה, וכך גם זמינותן הביולוגית לגופנו – כאשר זמינות הפולאט גבוהה בהרבה מזו של החומצה הפולית.
לפולאט יש תפקידים קריטיים בתהליכים ביוכימיים בגוף הקשורים לייצור הדנ"א והרנ"א, בהם תהליכי המתילציה – אחד המנגנונים העיקריים של האפי-גנטיקה, שמתרחש במולקולות הדנ"א ומשפיע על ביטוי הגנים. לכן, הוא חיוני לייצור ולחלוקת התאים [1, 2]. חסר בו, או פגמים בתהליכים שהוא מעורב בהם, עלולים להוביל לאנמיה מגלובלסטית (חוסר דם שמקורו בהפרעה בייצור הדנ"א), עקב הפרעה בשכפול ובייצור כדוריות אדומות במח העצם, ולירידה בתאי מערכת החיסון ובטסיות הדם [3, 4]. הפולאט קריטי במיוחד בתקופת ההיריון, כשחלוקת התאים מהירה, ולהתפתחות התקינה של העובר, ומחסור בו עלול להוביל להתפתחות לא תקינה של המוח וחוט השידרה של העובר, למומים מולדים חמורים או אף למות העובר [5]. במקביל, נמצא שהוספת חומצה פולית/פולאט בתקופה שלפני ההיריון עשויה להפחית את הסיכון ללידה מוקדמת ולמומים מולדים [6, 7, 8, 9, 10], וכן את הסיכון המוגבר ל-ASD (הפרעות על רצף האוטיזם) שנגרם כתוצאה מחשיפה טרום לידתית לתרופות ולכימיקלים שונים [11, 12, 13]
בנוסף, הפולאט ממלא תפקיד מרכזי (ביחד עם ויטמין B12) בפירוק חומצת האמינו הומוציסטאין, שרמות גבוהות שלה נקשרו לתהליכי דלקת ולסיכון מוגבר למחלות לב וכלי דם [1, 14, 15], דמנציה ואלצהיימר [16, 17, 18], ונמצא שתוספי פולאט (ו-B12) מפחיתים את הסיכון לשבץ [19, 20], וכי קיים קשר הפוך בין רמות הפולאט לבין הסיכון למספר סוגי סרטן [21, 22]. רמות נמוכות מקושרות גם לדיכאון [23, 24, 25].
במטרה למנוע חסר בפולאט במהלך ההיריון ממליצות רשויות הבריאות לנשים בגיל הפוריות ובמהלך ההיריון וההנקה ליטול באופן קבוע חומצה פולית במינון של 400 מיקרוגרם ליום [26, 27], ומדינות המערב אף מעשירות מזונות מעובדים, כגון קמחים ודגני בוקר, בחומצה פולית [1]. קבוצות נוספות שנמצאות בסיכון למחסור בפולאט וזקוקים לעתים קרובות להשלמה שלו הן אנשים הנושאים מוטציות בגנים הקשורים לתהליך חילוף החומרים של החומצה הפולית בגוף, או אנשים הסובלים מבעיות ספיגה בגלל מחלות מעי כמו קרוהן, קוליטיס וצליאק או בשל צריכת אלכוהול מרובה [1].
ואולם, בשנים האחרונות יותר ויותר מחקרים מצביעים על כך שבשל הזמינות הביולוגית הנמוכה של החומצה הפולית הסינתטית, היא נוטה להצטבר במחזור הדם [28, 29, 30], הצטברות אשר מקושרת להשלכות בריאותיות שליליות, כולל מחלות אוטואימוניות וסרטן [31]. יתר על כן, אצל אחוז ניכר מהאוכלוסייה, בשל מוטציה גנטית באנזים מרכזי המעורב בתהליך חילוף החומרים של החומצה הפולית בגוף, הסיכון להצטברותה גבוה במיוחד [32].
לאור ממצאים אלה מדגישים כיום חוקרים רבים את החשיבות של שימוש בתוספים המבוססים על פולאט במקום על חומצה פולית, ונעשו ניסיונות לפתח תרכובות פולאט שיגבירו את הזמינות הביולוגית של הוויטמין. פורמולה חדשנית – הדור ה-4 של פולאט, מבטיחה מסיסות וזמינות ביולוגית גבוהה במיוחד, וגם יציבות גבוהה יותר מזו של תרכובות הפולאט.
מהם בדיוק ההבדלים בין החומצה הפולית הסינתטית לפולאט, מדוע תוספי פולאט יעילים ובטוחים יותר מחומצה פולית, ומהם היתרונות של נגזרת הפולאט מהדור ה-4 על פני הנגזרת הוותיקה?
חומצה פולית לעומת פולאט – מה ההבדל בין הנגזרות?
למרות ההבדלים המובהקים בין נגזרת החומצה פולית לנגזרת הפולאט, השמות שלהן משמשים לעתים קרובות לסירוגין, ואפילו בקרב אנשי המקצוע יש לעתים בלבול ביניהן.
 מהו פולאט?
מהו פולאט?
פולאט, שהתגלה בשנות הארבעים של המאה הקודמת, הוא הצורה הפעילה ביולוגית של ויטמין B9, שנמצאת באופן טבעי במזונות מהטבע – ירקות, פירות, דגנים, קטניות, חלמון ביצה, כבד ועוד. השם 'פולאט' נגזר מהמילה הלטינית "folium", שפירושה עלה. ואכן, ירקות עליים הם בין המקורות התזונתיים הטובים ביותר של הוויטמין.
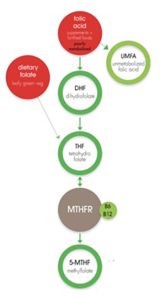
מרבית הפולאט התזונתי שאנו צורכים מומר במערכת העיכול שלנו, בתהליך אנזימטי המתרחש ברירית המעי, למתיל פולאט – (5-methyltetrahydrofolate או בקיצור 5-MTHF) – הנגזרת הפעילה ביולוגית של הוויטמין, שנכנסת למחזור הדם [33]
מהי חומצה פולית?
חומצה פולית היא צורה סינתטית של ויטמין B9. היא מכונה גם חומצה פטרוילמונוגלוטמית (pteroylmonoglutamic acid). נגזרת זו אינה קיימת בטבע, אלא מיוצרת באופן סינתטי בתהליכים תעשייתיים, והיא משמשת בתוספי תזונה, וכן כתוסף להעשרת מוצרי מזון מעובדים, כגון קמח, דגני בוקר, לחם מועשר ומיצי פירות. למעשה, מרבית תוספי התזונה מבוססים על חומצה פולית, שכן זוהי תרכובת זולה ויציבה.
החומצה הפולית שונה במבנה הכימי שלה מהנגזרת הטבעית – הפולאט, והיא איננה פעילה ביולוגית בגוף. כשאנו צורכים חומצה פולית, גופנו חייב להמירה תחילה למתיל-פולאט (5-MTHF) כדי שיוכל לנצל אותה. תהליך ההמרה, המערב אנזימים שונים, הינו מורכב ורב שלבי, ובשונה מהנגזרת הטבעית, רובו מתבצע בכבד [31]. הבעיה היא שתהליך זה הינו איטי, שכן לכבד יש יכולת מוגבלת להמיר את החומצה הפולית ל-5-MTHF, ולוקח לו זמן ממושך יותר לעשות זאת מאשר למערכת העיכול [31, 34]. כתוצאה מכך, ייתכן מצב שבו חומצה פולית שלא הומרה עדיין למתיל-פולאט (UFA), תגיע לזרם הדם ותצטבר בו.
ואכן, מחקרים זיהו במחזור הדם של אנשים הנוטלים תוספי חומצה פולית ו/או צורכים מזון המועשר בחומצה פולית רמות מוגברות של UFA [28, 29, 30]. זאת, אפילו כשהמינון היומי הנצרך קטן – 200-400 מיקרוגרם ליום, וברמות גבוהות במיוחד כשהמזון המועשר נצרך בנוסף לצריכת תוספי חומצה פולית [35]. מחקר שנערך בארצות הברית ב-2015 זיהה UFA כמעט בכל דגימות הדם מילדים ומבוגרים שניטלו במסגרת סקר לאומי לאחר העשרת הדגנים בחומצה פולית [36].
מדוע זה בעייתי?
מצב זה, של הצטברות החומצה הפולית במחזור הדם, מקושר להשלכות בריאותיות שליליות, שנבחנות בעשור האחרון על ידי הקהילה המדעית. אחת המרכזיות שבהן היא פגיעה בתגובה החיסונית של הגוף, שמתבטאת בין היתר, בהפחתת המספר והתפקוד של תאי הרג טבעיים (NK) (תאים במערכת החיסון שתפקידם העיקרי הוא חיסול תאי גוף שנדבקו בנגיפים או שהתפתחו לתאים סרטניים), ובעלייה בביטוי של גנים של חלבונים דלקתיים כמו TNFA ו- IL8 [37, 38]. כמו כן, צריכה מוגברת של חומצה פולית והצטברותה במחזור הדם נקשרה גם לפגיעה ורעילות בכבד [39]. בנוסף, הוכח שנטילת חומצה פולית בכמות גדולה (מעל 1 מ"ג ביום) עלולה למסך את הביטויים של אנמיה הנגרמת כתוצאה מחסר בוויטמין B12, וכתוצאה מכך להוביל לבעיות נוירולוגיות וקוגנטיביות [40]. יתירה מכך, חוקרים אף מעלים חשש שצריכה מתמשכת של חומצה פולית עלולה להגדיל את הסיכון לצמיחת גידולים סרטניים [31, 40], שכן צריכה כזו עלולה להוביל לחשיפה מתמשכת לרמות מוגברות של UFA הן של תאים נורמליים והן של תאים טרום סרטניים [40]. ממצאים ממחקרים מבוקרים ואקראיים [41, 42], וכן ממחקרים תצפיתיים [43, 44] הצביעו על עלייה בסיכון להישנות או להתפתחות של גידולים סרטניים, כמו סרטן המעי הגס וסרטן הערמונית, בעקבות תיסוף בחומצה פולית. אחד המנגנונים המשוערים הוא ההפחתה של תגובת תאי ההרג הטבעיים לתאים סרטניים כתוצאה מהצטברות החומצה הפולית בדם. מנגנון נוסף שהוצע הוא שרמות גבוהות של חומצה פולית בדם גורמות לתאים טרום סרטניים להתחלק בקצב מוגבר [31].
כאמור, אצל אחוז ניכר באוכלוסייה הסיכון להצטברות החומצה הפולית גבוה במיוחד [32]. זאת, מאחר שאנשים רבים נושאים מוטציה גנטית באנזים MTHFR, אשר משתתף בהמרת החומצה הפולית למתיל-פולאט. אצל אנשים עם מוטציה בגן האחראי לאנזים MTHFR, אנזים זה אינו פעיל בצורה מספקת, או אף אינו פעיל כלל. לכן, כשהם צורכים חומצה פולית – היא נוטה להצטבר בגופם ואינה הופכת לצורה הפעילה החיונית לתפקוד הרקמות. על פי פרויקט 1000 גנומים, כ-25% מאוכלוסיית העולם נשאית של אחת משתי המוטציות הגנטיות השכיחות ביותר ל-MTHFR – 677C>T, ו-25% נושאים את המוטציה השכיחה השנייה – 1298A>C [45].
כאמור, ממצאים אלה הובילו בשנים האחרונות חוקרים רבים להמליץ על שימוש בתוספים המבוססים על פולאט במקום על חומצה פולית.
נגזרת הדור ה-4 של הפולאט לעומת הנגזרת הוותיקה – מה ההבדל?
הגרסה הוותיקה של הפולאט, שאותה מכילים מותגי פולאט רבים כיום, מבוססת על פורמולה המשלבת מלח סידן של 5-MTHF (פורמולה שנקראת 5MTHF-Ca). או במלים אחרות – מלח סידן של מתיל-פולאט.
לעומת זאת, נגזרת הדור ה-4 מבוססת על פורמולה משופרת, המכילה רכיב פטנטי שנקרא ®Quatrefolic. רכיב זה משלב מלח גלוקוזאמין של 5-MTHF במקום מלח סידן. דהיינו – מלח גלוקוזאמין של מתיל-פולאט [46].
מלח גלוקוזאמין הוא תרכובת טבעית המיוצרת בגוף האדם ואשר נמצאת כמעט בכל הרקמות האנושיות. הגלוקוזאמין מורכב מגלוקוז ומחומצת האמינו גלוטמין, והוא חיוני לייצור גליקוזאמינוגלקינים (מולקולות המשמשות ליצירה ולתיקון סחוסים ורקמות אחרות בגוף). הוא נמצא למעשה בשימוש נרחב כתוסף תזונה במשך שנים רבות – לבדו או בשילוב עם מוצרים אחרים, כך שפרופיל הבטיחות שלו מוכר היטב. מאחר שהגלוקוזאמין נטול בעלי חיים ורכיכות, Quatrefolic מתאים גם לצמחונים [47].
מה הופך את נגזרת הדור ה-4 ליעילה במיוחד?
הגורמים מרכזיים הממלאים תפקיד חשוב בפיתוח תוספי פולאט זמינים ביולוגית הם יציבות ומסיסות. למעשה, בעיית היציבות של הנגזרת הטבעית של מתיל-פולאט השלטת בגופנו (5-MTHF) הייתה הסיבה שבשלה פותחה החומצה הפולית הסינתטית. בעוד שהמסיסות במים של 5-MTHF הינה גבוהה מאוד, הרי שהיציבות שלה מוגבלת, ומסיבה זו, פיתוח תוספי תזונה המבוססים עליה לא היה אפשרי [48]. כמענה לבעיה פותחה בתחילה הנגזרת הסינתטית, שהיא בעלת יציבות גבוהה – אם כי, כאמור, זמינות ביולוגית נמוכה הרבה יותר.
בהמשך, פיתוח פורמולת 5MTHF-Ca (מלח הסידן) איפשרה להשיג את שני העולמות – נגזרת מתיל-פולאט הפעילה וזמינה ביולוגית לגופנו, אך יציבה יותר ממנו כך שניתן להשתמש בה בתוספי תזונה (48). עם זאת, נגזרת מלח הסידן מאופיינת במסיסות לא מאוד טובה במים [46].
במטרה לשפר את המסיסות והיציבות פותחה נגזרת הדור ה-4 – Quatrefolic, תוך שימוש במלח גלוקוזאמין. מחקרים שבחנו את פעילות הפורמולה ואת זמינותה הביולוגית מצאו שהיא גם יציבה מאוד וגם בעלת מסיסות גבוהה במים, כאשר מלח הגלוקוזאמין, המשמש כנשא, מאפשר לפולאט לחצות את מחסום הקיבה ולהיספג ברירית המעי הדק. לכן, הפורמולה מספקת פולאט הזמין מידית לגוף – שעוקף למעשה את בעיית המוטציות ב-MTHFR [46, 48, 49, 34].
מחקרים בבעלי חיים ומחקרים קליניים בבני אדם הראו שהיא אכן זמינה ביולוגית – כשחלקם אף הראו שהזמינות גבוהה אף יותר מזו של מלח הסידן. כך לדוגמה, מחקר שנערך בחולדות השווה בין הזמינות הביולוגית של Quatrefolic עם פורמולת מלח הסידן ועם חומצה פולית [50]. החולדות חולקו לשלוש קבוצות, כשאחת מהן קיבלה חומצה פולית, השנייה מלח סידן, והשלישית Quatrefolic במינון זהה. החוקרים מצאו שריכוז הפולאט בפלזמה של החיות שקיבלו את פורמולת Quatrefolic הייתה גבוהה פי 3.1 מזו של הקבוצה שקיבלה את החומצה הפולית, ופי 1.8 מזה של הקבוצה שקיבלה את מלח הסידן. כמו כן, הזמינות הביולוגית של פורמולת Quatrefolic הייתה גבוהה פי 9.7 מזו של החומצה הפולית, ופי 1.12 (כ-10%) יותר מזו של פורמולת מלח הסידן. הם הסיקו שהזמינות הביולוגית של Quatrefolic גבוהה משמעותית יותר הן מזו של החומצה הפולית והן מזו של פורמולת מלח הסידן. לדבריהם, הסיבה לכך נעוצה במסיסות הגבוהה יותר של מלח הגלוקוזאמין במים, כך שהפולאט נספג טוב יותר ברירית המעי.
ממצאים דומים עלו גם במחקרים קליניים. כך למשל, במחקר שבו קיבלו אנשים עם יתר לחץ דם תוסף של פורמולת מלח הסידן במינון של 400 מיקרוגרם במשך חודשיים, לעומת פורמולת מלח גלוקוזאמין, נמצא שמלח הגלוקוזאמין היה יעיל יותר בהפחתת רמות ההומציטסאין מאשר החומצה הפולית [51].
מחקרים בנשים הרות – קליניים ותצפיתיים, הצביעו אף הם על יעילות גבוהה של ה- Quatrefolic. כך, נמצא שמתן תוסף שלו לנשים הרות עד השבוע ה-24 להיריון היה יעיל יותר בהעלאת רמות הפולאט בדם לעומת אותו מינון של חומצה פולית [52]. ומחקר נוסף הראה גם שריכוזי הפולאט בתאי האדם האדומים עלו יותר לאחר נטילת תוסף Quatrefolic, בהשוואה לחומצה פולית, במשך 12-24 שבועות [53]. במחקר תצפיתי עקבו חוקרים אחרי 7 זוגות עם יותר מחמש הפלות שקיבלו בעבר, ללא הועיל, חומצה פולית במטרה למנוע הפלות. בחמישה מהזוגות – שני בני הזוג נשאו את המוטציה העיקרית לאנזים MTHFR (C677T). לאחר שהנשים קיבלו במשך ארבעה חודשים 400 מיקרוגרם ליום של Quatrefolic- שש מהן הרו, כשלאורך המעקב שלוש מהן ילדו, שתיים היו בשבועות 16 ו-25, והשישית הייתה בתחילת ההיריון [54].
בנוסף ליעילותה הגבוהה, נמצא שפורמולת מלח הגלוקוזאמין גם בטוחה יותר לשימוש, שכן היא זמינה לשימוש ישיר על ידי התאים, ולכן לא מובילה להצטברות של חומצה פולית במחזור אדם, או למיסוך אנמיה מחוסר ב-B12 [34].
אנו גאים להשיק את הפורמולה החדשה המבוססת על Quatrefolic הפטנטי, שמייצג את הדור הרביעי של פולאט. התוסף הוא בעל אישור בטיחות GRAS (חומרים הנחשבים כבטוחים – Generally Recognized as Safe).
למען הסר ספק מודגש בזאת כי המוצרים המופיעים במאמר זה, הינם תוספי תזונה ואינם תרופות. אין לראות במוצרים או באמור בנוגע אליהם ככאלו שנועדו לאבחן, לטפל, לרפא או למנוע מחלה כלשהי. המידע אינו המלצה או הוראה או דרך לטיפול רפואי. בכל מקרה של בעיה רפואית יש להיוועץ ברופא המטפל לפני נטילת תוספי מזון וויטמינים.
כמו כן, המידע אינו מהווה המלצה רפואית מוסמכת ואינו מיועד להנחות את המשתמש ו/או את הציבור ו/או לשמש לגביו כהמלצה או הוראה או עצה לשימוש או שינוי או הורדה של תרופה כלשהי, ואין בו תחליף לייעוץ רפואי פרטני או אחר. כמו כן, המינונים והנחיות הנטילה המופיעים במאמר זה, הינם כלליים ויש להיוועץ בגורם מטפל מוסמך כדי להתאימם אישית בהתאם לגיל ולמצב הרפואי. נשים בהיריון, נשים מניקות, ילדים והנוטלים תרופות מרשם – יש להיוועץ ברופא לפני השימוש בתוספי תזונה
מקורות
- US National Institutes of Health. (2021). Folate – Fact Sheet for Health Professionals. Office of Dietary Supplements. http://ods.od.nih.gov/factsheets/folate/
- Crider, K.S., Yang, T.P., Berry, R.J., & Bailey, L.B. (2012). Folate and DNA Methylation: A Review of Molecular Mechanisms and the Evidence for Folate's Role. Adv Nutr, 3(1): 21–38. doi: 10.3945/an.111.000992. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3262611/
- Socha, D.S., DeSouza, S.I., Flagg, A., Sekeres, M., & Rogers, H.J. (2020). Severe megaloblastic anemia: vitamin deficiency and other causes. Cleve Clin J Med, 87(3):153–164. doi:10.3949/ccjm.87a.19072 https://www.ccjm.org/content/87/3/153
- Carmel R. Folic acid. In: Shils M, Shike M, Ross A, Caballero B, Cousins RJ, eds. Modern Nutrition in Health and Disease. 11th ed. Baltimore, MD: Lippincott Williams & Wilkins; 2005:470-81. https://pure.johnshopkins.edu/en/publications/modern-nutrition-in-health-and-disease-eleventh-edition
- Crider, K.S., Bailey, L.B., & Berry, R.J. (2011). Folic acid food fortification-its history, effect, concerns, and future directions. Nutrients, 3(3):370-84. doi: 10.3390/nu3030370. Epub 2011 Mar 15. PMID: 22254102; https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3257747/
- Smithells, R.W., Nevin, N.C., Seller, M.J., Sheppard, S., Harris, R., Read, A.P., Fielding, D.W., Walker, S., Schorah, C.J., & Wild, J. (1983). Further experience of vitamin supplementation for prevention of neural tube defect recurrences. Lancet, 7;1(8332):1027-31. doi: 10.1016/s0140-6736(83)92654-5. https://pubmed.ncbi.nlm.nih.gov/6133069/
- Sutton, M., Daly, L.E., & Kirke, P.N. (2008). Survival and disability in a cohort of neural tube defect births in Dublin, Ireland. Birth Defects Res A Clin Mol Teratol, 82(10):701-9. doi: 10.1002/bdra.20498. https://pubmed.ncbi.nlm.nih.gov/18803309
- Hibbard, B.M., Hibbard, E.D., & Jeffcoate, T.N. (1965). Folic acid and reproduction. Acta Obstet Gynecol Scand, 44(3):375-400. doi: 10.3109/00016346509155874. PMID: 5863074. https://pubmed.ncbi.nlm.nih.gov/5863074
- MRC Vitamin Study Research Group. (1991). Prevention of neural tube defects: results of the Medical Research Council Vitamin Study. Lancet, 20;338(8760):131-7. https://pubmed.ncbi.nlm.nih.gov/1677062
- Liu, S., Joseph, K.S., Luo, W., León, J.A., Lisonkova, S., Van den Hof, M., Evans, J., Lim, K., Little, J., Sauve, R., Kramer, M.S. Canadian Perinatal Surveillance System (Public Health Agency of Canada). (2016). Effect of Folic Acid Food Fortification in Canada on Congenital Heart Disease Subtypes. Circulation, 30;134(9):647-55. doi: 10.1161/CIRCULATIONAHA.116.022126. PMID: 27572879; PMCID: PMC4998126. https://pubmed.ncbi.nlm.nih.gov/27572879/
- Suren, P., Roth, C., Bresnahan, M. et al. (2013). Association between maternal use of folic acid supplements and risk of autism spectrum disorders in children. JAMA, 309:570-7. https://pubmed.ncbi.nlm.nih.gov/23403681/
- Schmidt, R.J., Tancredi, D.J., Ozonoff, S., et al. (2012). Maternal periconceptional folic acid intake and risk of autism spectrum disorders and developmental delay in the CHARGE (CHildhood Autism Risks from Genetics and Environment) case-control study. Am J Clin Nutr, 96:80-9. https://pubmed.ncbi.nlm.nih.gov/22648721/
- Levine, S.Z., Kodesh, A., Viktorin, A., et al. (2018). Association of maternal use of folic acid and multivitamin supplements in the periods before and during pregnancy with the risk of autism spectrum disorder in offspring. JAMA Psychiatry, 75:176-84. https://pubmed.ncbi.nlm.nih.gov/29299606/
- Ganguly, P., & Alam, S.F. (2015). Role of homocysteine in the development of cardiovascular disease. Nutr J, 14:6. doi: 10.1186/1475-2891-14-6. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4326479/
- Baszczuk, A., & Kopczyński, Z. (2014). Hyperhomocysteinemia in patients with cardiovascular disease. Advances in Hygiene and Experimental Medicine, 68:579-589. https://doi.org/10.5604/17322693.1102340.
- Ho, R.C., Cheung, M.W., Fu, E., Win, H.H., Zaw, M.H., Ng, A., & Mak, A. (2011). Is high homocysteine level a risk factor for cognitive decline in elderly? A systematic review, meta-analysis, and meta-regression. Am J Geriatr Psychiatry, 19(7):607-17. doi: 10.1097/JGP.0b013e3181f17eed. https://pubmed.ncbi.nlm.nih.gov/21705865/
- Kim, S., Choi, B.Y., Nam, J.H., Kim, M.K., Oh, D.H., & Yang, Y.J. (2019). Cognitive impairment is associated with elevated serum homocysteine levels among older adults. Eur J Nutr, 58(1):399-408. doi: 10.1007/s00394-017-1604-y. https://pubmed.ncbi.nlm.nih.gov/29322314/
- Seshadri, S., Beiser, A., Selhub, J., Jacques, P.F., Rosenberg, I.H., D'Agostino, R.B., Wilson, P.W., Wolf, P.A. (2002). Plasma homocysteine as a risk factor for dementia and Alzheimer's disease. N Engl J Med, 346(7):476-83. doi: 10.1056/NEJMoa011613. https://pubmed.ncbi.nlm.nih.gov/11844848/
- Huo, Y., Qin, X., Wang, J., Sun, N., Zeng, Q., Xu, X., Liu, L., Xu, X., & Wang, X. (2012). Efficacy of folic acid supplementation in stroke prevention: new insight from a meta-analysis. Int J Clin Pract, 66(6):544-51. doi: 10.1111/j.1742-1241.2012.02929.x. https://pubmed.ncbi.nlm.nih.gov/22607506/
- Jenkins, D.J.A., Spence, J.D., Giovannucci, E.L., Kim, Y.I., Josse, R., Vieth, R., Blanco, Mejia. S., Viguiliouk, E., Nishi, S., Sahye-Pudaruth, S., Paquette, M., Patel, D., Mitchell, S., Kavanagh, M., Tsirakis, T., Bachiri, L., Maran, A., Umatheva, N., McKay, T., Trinidad, G., Bernstein, D., Chowdhury, A., Correa-Betanzo, J., Del Principe, G., Hajizadeh, A., Jayaraman, R., Jenkins, A., Jenkins, W., Kalaichandran, R., Kirupaharan, G., Manisekaran, P., Qutta, T., Shahid, R., Silver, A., Villegas, C., White, J., Kendall, C.W.C., Pichika, S.C., Sievenpiper, J.L. (2018). Supplemental Vitamins and Minerals for CVD Prevention and Treatment. J Am Coll Cardiol, 5;71(22):2570-2584. doi: 10.1016/j.jacc.2018.04.020. https://pubmed.ncbi.nlm.nih.gov/29852980/
- Bailey, L.B., Stover, P.J., McNulty, H., et al. (2015). Biomarkers of nutrition for development-folate review. J Nutr, 145:1636S-80S. https://pubmed.ncbi.nlm.nih.gov/26451605/
- He ,H., & Shui, B. (2014). Folate intake and risk of bladder cancer: a meta-analysis of epidemiological studies. Int J Food Sci Nutr, 65:286-92. https://pubmed.ncbi.nlm.nih.gov/24328495/
- Huang, X., Fan, Y., Han, X., et al. (2018). Association between serum vitamin levels and depression in U.S. adults 20 years or older based on National Health and Nutrition Examination Survey 2005-2006. Int J Environ Res Public Health, 15. https://pubmed.ncbi.nlm.nih.gov/29890739/
- Gougeon ,L., Payette, H., Morais, J.A., et al. (2016). Intakes of folate, vitamin B6 and B12 and risk of depression in community-dwelling older adults: the Quebec Longitudinal Study on Nutrition and Aging. Eur J Clin Nutr, 70:380-5. https://pubmed.ncbi.nlm.nih.gov/26648330/
- Morris ,M.S., Fava, M., Jacques, P.F., et al. (2003). Depression and folate status in the US population. Psychother Psychosom, 72:80-7. https://pubmed.ncbi.nlm.nih.gov/12601225/
- Centers for Disease Control and Prevention. Folic acid 2012.
- US Preventive Services Task Force; Bibbins-Domingo, K., Grossman, D.C., Curry, S.J., Davidson, K.W., Epling, J.W. Jr, García, F.A., Kemper, A.R., Krist, A.H., Kurth, A.E., Landefeld, C.S., Mangione, C.M., Phillips, W.R., Phipps, M.G., Pignone, M.P., Silverstein, M., Tseng, & C.W. (2017). Folic Acid Supplementation for the Prevention of Neural Tube Defects: US Preventive Services Task Force Recommendation Statement. JAMA, 10;317(2):183-189. doi: 10.1001/jama.2016.19438. https://pubmed.ncbi.nlm.nih.gov/28097362/
- Obeid, R., Kirsch, S.H., Dilmann, S., Klein, C., Eckert, R., Geisel, J., & Herrmann, W. (2015). Folic acid causes higher prevalence of detectable unmetabolized folic acid in serum than B-complex: a randomized trial. Eur J Nutr, 55(3):1021-8. doi: 10.1007/s00394-015-0916-z. https://www.ncbi.nlm.nih.gov/pubmed/25943647
- Plumptre ,L., Masih, S.P., Ly, A., Aufreiter, S., Sohn, K.J., Croxford, R., Lausman, A,Y., Berger, H., O'Connor, D.L., Kim, Y.I. (2015). High concentrations of folate and unmetabolized folic acid in a cohort of pregnant Canadian women and umbilical cord blood. Am J Clin Nutr. 2015, 102(4):848-57. doi: 10.3945/ajcn.115.110783. https://www.ncbi.nlm.nih.gov/pubmed/26269367
- Sweeney, M.R., Staines, A., Daly, L. et al. (2009). Persistent circulating unmetabolised folic acid in a setting of liberal voluntary folic acid fortification. Implications for further mandatory fortification?. BMC Public Health 9, 295. https://doi.org/10.1186/1471-2458-9-295 https://bmcpublichealth.biomedcentral.com/articles/10.1186/1471-2458-9-295
- Patel, K., & Sobczyńska-Malefora, A. (2017). The adverse effects of an excessive folic acid intake. Eur J Clin Nutr, 71, 159–163. https://doi.org/10.1038/ejcn.2016.194 https://www.nature.com/articles/ejcn2016194
- Krishnaveni, G.V., Veena, S.R., Karat, S.C., & Yajnik, C.S., Fall, C.H. (2014). Association between maternal folate concentrations during pregnancy and insulin resistance in Indian children. Diabetologia, 7(1):110-21. doi: 10.1007/s00125-013-3086-7. https://pubmed.ncbi.nlm.nih.gov/24162586/
- Alpers, D.H. (2016). Absorption and blood/cellular transport of folate and cobalamin: Pharmacokinetic and physiological considerations. Biochimie, 126:52-6. doi: 10.1016/j.biochi.2015.11.006. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4867132/
- Carboni, L. (2022). Active Folate Versus Folic Acid: The Role of 5-MTHF (Methylfolate) in Human Health. Integr Med (Encinitas), 21(3):36-41. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9380836/
- Bailey, S.W, Ayling, J.E. The Extremely Slow and Variable Activity of Dihydrofolate Reductase in Human Liver and its Implications for High Folic Acid Intake. Proc Natl Acad Sci USA. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2730961/
- Pfeiffer, C.M., Sternberg, M.R., Fazili, Z., Yetley, E.A., Lacher, D.A., Bailey, R.L., Johnson, C.L. (2015). Unmetabolized folic acid is detected in nearly all serum samples from US children, adolescents, and adults. J Nutr, 145(3):520-31. doi: 10.3945/jn.114.201210. Epub 2014 Dec 10. PMID: 25733468; PMCID: PMC4336532. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4336532/
- Troen, A.M., Mitchell, B., Sorensen, B., Wener, M.H., Johnston, A., Wood, B., Selhub, J., McTiernan, A., Yasui, Y., Oral, E., Potter, J.D., Ulrich, C.M. (2006). Unmetabolized folic acid in plasma is associated with reduced natural killer cell cytotoxicity among postmenopausal women. J Nutr, 136(1):189-94. doi: 10.1093/jn/136.1.189. https://pubmed.ncbi.nlm.nih.gov/16365081/
- Paniz, C., Bertinato, J.F., Lucena, M.R., De Carli, E., Amorim, P.M.D.S, Gomes, G.W., Palchetti, C.Z., Figueiredo, M.S., Pfeiffer, C.M., Fazili, Z., Green, R., Guerra-Shinohara, E.M. (2017). A Daily Dose of 5 mg Folic Acid for 90 Days Is Associated with Increased Serum Unmetabolized Folic Acid and Reduced Natural Killer Cell Cytotoxicity in Healthy Brazilian Adults. J Nutr, 147(9):1677-1685. doi: 10.3945/jn.117.247445. https://pubmed.ncbi.nlm.nih.gov/28724658/
- Christensen, K.E. Mikael, L.G. Leung, K.Y. Lévesque, N. Deng, L. Wu, Q. et al. (2015). High folic acid consumption leads to pseudo-MTHFR deficiency, altered lipid metabolism, and liver injury in mice Am. J. Clin. Nutr, 101:646-658. https://www.sciencedirect.com/science/article/pii/S0002916523273220?via%3Dihub
- Sweeney, M.R., Staines, A., Daly, L., Traynor, A., Daly, S., Bailey, S.W., Alverson, P.B., Ayling, J.E., & Scott, J.M. (2009). Persistent circulating unmetabolised folic acid in a setting of liberal voluntary folic acid fortification. Implications for further mandatory fortification? BMC Public Health, 18;9:295. doi: 10.1186/1471-2458-9-295. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2734856/
- Cole, B.F., Baron, J.A., Sandler, R.S., Haile, R.W., Ahnen, D.J., Bresalier, R.S., McKeown-Eyssen, G., Summers, R.W., Rothstein, R.I., Burke, C.A., Snover, D.C., Church, T.R., Allen, J.I., Robertson, D.J., Beck, G.J., Bond, J.H., Byers, T., Mandel, J.S., Mott, L.A., Pearson, L.H., Barry, E.L., Rees, J.R., Marcon, N., Saibil, F., Ueland, P.M., Greenberg, E.R.; Polyp Prevention Study Group. (2007). Folic acid for the prevention of colorectal adenomas: a randomized clinical trial. JAMA, 6;297(21):2351-9. doi: 10.1001/jama.297.21.2351. https://pubmed.ncbi.nlm.nih.gov/17551129/
- Figueiredo, J.C., Grau, M.V., Haile, R.W., Sandler, R.S., Summers, R.W., Bresalier, R.S., Burke, C.A., McKeown-Eyssen, G.E., Baron, J.A. (2009). Folic acid and risk of prostate cancer: results from a randomized clinical trial. J Natl Cancer Inst, 18;101(6):432-5. doi: 10.1093/jnci/djp019. Epub 2009 Mar 10. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2657096/
- Hirsch, S., Sanchez, H., Albala, C., de la Maza, M.P., Barrera, G., Leiva, L., Bunout, D. (2009). Colon cancer in Chile before and after the start of the flour fortification program with folic acid. Eur J Gastroenterol Hepatol, 21(4):436-9. doi: 10.1097/MEG.0b013e328306ccdb. https://pubmed.ncbi.nlm.nih.gov/19190501/
- Mason, J.B., Dickstein, A., Jacques, P.F., Haggarty, P., Selhub, J., Dallal, G., Rosenberg, I.H. (2007). A temporal association between folic acid fortification and an increase in colorectal cancer rates may be illuminating important biological principles: a hypothesis. Cancer Epidemiol Biomarkers Prev, 16(7):1325-9. doi: 10.1158/1055-9965. https://pubmed.ncbi.nlm.nih.gov/17626997/
- 1000 Genomes Project Consortium; Auton, A., Brooks, L.D., Durbin, R.M., Garrison, E.P., Kang, H.M., Korbel, J.O., Marchini, J.L., McCarthy, S., McVean, G.A., Abecasis, G.R. (2015). A global reference for human genetic variation. Nature, 1;526(7571):68-74. doi: 10.1038/nature15393. PMID: 26432245; https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4750478/
- Miraglia, N., Agostinetto, M., Bianchi, D., & Valoti, E. (2016). Enhanced oral bioavailability of a novel folate salt: comparison with folic acid and a calcium folate salt in a pharmacokinetic study in rats. Minerva Ginecol, 68(2):99–105. https://www.minervamedica.it/en/getfreepdf/SFRPWjJFbU5oTTJhNmYyZGxyQUlSbW1MNzFsQ0tNNytJVWN6R2xIZWRYOXRoRTRjMHhnTWQzS2FUaWNJYnBDSA%253D%253D/R09Y2016N02A0099.pdf
- Quatrefolic®. https://quatrefolic.com/what-is-quatrefolic/
- Pietrzik, K., Bailey, L., Shane, B. (2010). Folic acid and L-5-methyltetrahydrofolate: comparison of clinical pharmacokinetics and pharmacodynamics Clin Pharmacokinet, 49 (8): 535-548 https://www.sciencedirect.com/science/article/pii/S2161831322003076#bib18
- I.N. Kononova, I.N., Kareva, E.N., & Dobrokhotova, Yu.E. (2022). Fourth-generation folic acid active metabolite Quatrefolic® and micronized, microencapsulated iron Lipofer®: innovative approaches for iron and folic acid deficiencies in women (a review). Russian Journal of Woman and Child Health, 5(1):18-27. DOI:10.32364/2618-8430-2022-5-1-18-27 https://www.researchgate.net/profile/Anastasia-Zagarskikh/publication/359554525_HLA_class_II_alleles_in_couples_with_failed_ART_attempts/links/62c283be894d625717c56544/HLA-class-II-alleles-in-couples-with-failed-ART-attempts.pdf#page=20
- Miraglia, N., Agostinetto, M., Bianchi, D., & Valoti, E. (2016). Enhanced oral bioavailability of a novel folate salt: comparison with folic acid and a calcium folate salt in a pharmacokinetic study in rats. Minerva Ginecol, 68(2):99–105. https://pubmed.ncbi.nlm.nih.gov/27008238/
- Mazza, A., Cicero, A.F., Ramazzina, E., et al. (2016). Nutraceutical approaches to homocysteine lowering in hypertensive subjects at low cardiovascular risk: a multicenter, randomized clinical trial. J Biol Regul Homeost Agents, 30(3):921-927. https://pubmed.ncbi.nlm.nih.gov/27655522
- Dell’Edera, D., Sarlo, F., Allegretti, A., et al. (2017). Prevention of neural tube defects and maternal gestational diabetes through the inositol supplementation: preliminary results. Eur Rev Med Pharmacol Sci, 21(14):3305-3311. https://pubmed.ncbi.nlm.nih.gov/28770950
- Lamers, Y., Prinz-Langenohl, R., Brämswig, S., & Pietrzik, K. (2006). Red blood cell folate concentrations increase more after supplementation with [6S]-5- methyltetrahydrofolate than with folic acid in women of childbearing age. Am J Clin Nutr, 84(1):156–161. DOI: 10.1093/ajcn/84.1.156. https://pubmed.ncbi.nlm.nih.gov/16825690/
- Servy, E., & Menezo, Y. (2017). The Methylene Tetrahydrofolate Reductase (MTHFR) isoform challenge. High doses of folic acid are not a suitable option compared to 5 Methyltetrahydrofolate treatment. Clin Obstet Gynecol Reprod Med, 3(6). doi:10.15761/COGRM.1000204 https://m.script-one.com/pdf/COGRM-3-204.pdf
עוד כתבות מעניינות באותו נושא
מוצרים שאולי יעניינו אותך